Теорія хімічного зв’язку та будова речовини
План
3.1 Основні типи хімічного зв’язку і причини його утворення. Теорія валентних зв’язків
3.2 Ковалентний зв’язок. Напрямленість та насичуваність ковалентного зв’язку. Гібридизація атомних орбіталей. Геометрія молекул. Полярність і поляризація молекул
3.3 Теорія молекулярних орбіталей МО ЛКАО
3.4 Характерні особливості йонного зв'язку: ненасиченість, ненапрямленість
3.5 Металічний зв'язок
3.6 Міжмолекулярна взаємодія. Водневий зв'язок
3.7 Зв'язок між типом хімічного зв'язку, будовою речовини та її фізичними властивостями. Атомні, молекулярні, йонні та металічні кристали
3.1 Основні типи хімічного зв’язку і причини його утворення. Теорія валентних зв’язків
Як відомо, в природі будь-яка матеріальна система спонтанно намагається досягти стану, що характеризується мінімальною потенціальною енергією, тобто стану максимальної стабільності.
Саме з цієї причини вода гірських озер сходить в долини; стиснута пружина намагається розправитись.
Відомо також, що атоми, дуже рідко існують в ізольованому стані, більшість їх об’єднується з утворенням молекул. Це дає підстави думати, що під час утворення молекули атоми досягають більш енергетично стабільного стану.
Зв’язок, що утворюється між атомами однакових або різних елементів для досягнення енергетично стабільного стану називається хімічним зв’язком.
Щоб зрозуміти, як між атомами утворюється зв’язок, необхідно пригадати, що вони складаються із позитивно зарядженого ядра та негативно заряджених електронів. За рахунок наявності зарядів протилежного знаку між двома атомами виникають сили притягання (ядро-електрони) і відштовхування (ядро-ядро; електрони-електрони).
Відстань, на якій сили притягання і відштовхування між атомами урівноважуються і система досягає мінімального енергетичного стану, називається довжиною зв’язку.
Утворення хімічного зв’язку між атомами супроводжується вивільненням певної кількості енергії, яка називається енергією зв’язку. Чим більша кількість енергії виділяється, тим міцніший утворюється зв’язок і тим коротша довжина зв’язку.
Американський вчений Дж. Льюіс в 1916 р. заклав основи сучасної інтерпретації хімічного зв’язку, визначивши, що участь в утворенні зв’язку приймають електрони зовнішнього енергетичного рівня (валентні електрони). У s- і р-елементів валентними є електрони зовнішнього енергетичного рівня, у d-елементів – s-електрони зовнішнього і d-електрони передостаннього енергетичного рівня.
Залежно від характеру розподілу валентних електронів у речовині, розрізняють три основних типи хімічного зв'язку: ковалентний, йонний та металічний.
Отже, описати хімічний зв'язок у речовині означає встановити, як саме розподіляється електронна густина. Проте для цього треба розв'язати рівняння Шредінгера, яке має розв'язок для йона Н , тобто для системи з двох протонів і одного електрона. Для систем з двома і більшим числом електронів застосовують наближені методи обчислення хвильової функції або наближено визначають розподіл електронної густини в молекулі. Найпоширенішими є два методи: метод валентних зв'язків (ВЗ) і метод молекулярних орбіталей (МО). У розвитку першого методу особлива заслуга належить В. Гейтлеру і Ф. Лондону, Дж. Слетеру і Л. Полінгу, у розвитку другого методу – Р. Маллікену і Ф. Гунду.
, тобто для системи з двох протонів і одного електрона. Для систем з двома і більшим числом електронів застосовують наближені методи обчислення хвильової функції або наближено визначають розподіл електронної густини в молекулі. Найпоширенішими є два методи: метод валентних зв'язків (ВЗ) і метод молекулярних орбіталей (МО). У розвитку першого методу особлива заслуга належить В. Гейтлеру і Ф. Лондону, Дж. Слетеру і Л. Полінгу, у розвитку другого методу – Р. Маллікену і Ф. Гунду.
Основне положення, на якому ґрунтуються методи валентних зв'язків і молекулярних орбіталей, полягає в тому, що багатоелектронна хвильова функція для молекули утворюється з одноелектронних функцій (кожна електронна функція описує відповідний електрон молекули).У цих методах використовуються різні підходи до побудови вихідної хвильової функції й різні уявлення про електронну будову молекули.
Метод валентних зв'язків ґрунтується на положенні, що кожна пара атомів у молекулі утримується разом за допомогою електронних пар, тобто хімічний зв'язок, локалізований між двома атомами, – двоелектронний і двохцентровий; він утворюється внаслідок перекривання атомних електронних хмар (рис. 3.1). У місці перекривання електронних хмар, тобто у просторі між атомами, електронна густина максимальна. Це означає, що ймовірність перебування електронів у просторі між ядрами більша, ніж в інших місцях молекули. Завдяки цьому зростають сили притягання між позитивним зарядом ядра і негативними зарядами електронів, що приводить до утворення молекули.
Метод валентних зв'язків дає більш наочне уявлення про будову молекул, характерні особливості ковалентного зв'язку (насиченість, напрямленість і полярність), тому він частіше застосовується для якісного розв'язання питань хімічного зв'язку.
3.2 Ковалентний зв’язок. Напрямленість та насичуваність
ковалентного зв’язку.
ковалентного зв’язку.
Гібридизація атомних орбіталей. Геометрія молекул. Полярність і поляризація молекул
Механізм утворення хімічного зв’язку з погляду теорії валентних зв'язків на прикладі молекули водню:
Н·+·Н =Н:Н + 431кДж
Згідно із квантово-механічними уявленнями, ядро вільного атома Гідрогену оточене електронною хмарою кулястої форми, яка відповідає
ls-електрону (рисунок 3.1). При зближенні атомів На і Нb між ними виникають електростатичні сили двох типів – сили відштовхування і сили притягання. Внаслідок перекривання електронних хмар у просторі між ядрами цих атомів виникає ділянка підвищеної електронної густини.
ls-електрону (рисунок 3.1). При зближенні атомів На і Нb між ними виникають електростатичні сили двох типів – сили відштовхування і сили притягання. Внаслідок перекривання електронних хмар у просторі між ядрами цих атомів виникає ділянка підвищеної електронної густини.

Рисунок 3.1 – Утворення молекули водню
 |
Потенціальна енергія такої системи залежить від між’ядерної відстані і від відношення спінів електронів. Якщо вони паралельні, то за будь-якої ядерної відстані спостерігається відштовхування між атомами (рисунок 3.2, крива а). У випадку антипаралельних спінів домінують сили притягання (рисунок 3.2, крива б).
Для двох атомів Гідрогену оптимальною є між’ядерна відстань 0,074нм =0,74 Å, Еmin= 431 кДж/моль – енергія зв'язку (найбільш стійкий стан).
Потенціальна енергія молекули на 4 еВ менша, ніж сумарна потенціальна енергія ізольованих атомів, що відповідає принципу найменшої енергії: чим меншою енергією володіє система, тим вона стійкіша.
|
Хімічний зв'язок, який утворюється шляхом узагальнення електронної пари, називається ковалентним, а число утворених електронних пар (хімічних зв'язків) – ковалентністю.
Існує й інший механізм утворення ковалентного зв’язку донорно-акцепторний, який виникає за рахунок перекриття двоелектронної орбіталі одного атома (донора) з вільною орбіталлю іншого атома (акцептора):

В утворенні зв'язку можуть приймати участь не лише s-, р-, але й
d-орбіталі. Такий зв'язок називають донорно-акцепторним або координаційним.
d-орбіталі. Такий зв'язок називають донорно-акцепторним або координаційним.
Під час утворення зв'язку енергія завжди виділяється (енергія зв'язку), таку ж кількість енергії необхідно затратити на її розрив (енергія дисоціації). Енергія зв'язку – це міра його міцності, яка вимірюється в кДж/моль або еВ/моль (знаходиться в широких межах 100…1000 кДж/моль).
Таким чином, хімічний зв'язок характеризується енергією, довжиною зв'язку, які визначають його міцність, та валентним кутом (див. нижче).
Напрямленість хімічних зв’язків. Відповідно до методу ВЗ хімічний зв'язок між атомами зумовлюється перекриванням s-, p-, d- і f-орбіталей, які (крім s-орбіталі) мають напрямленість у просторі. Тому і хімічний зв'язок, який утворюється за їх участю, має в просторі певну напрямленість. Оскільки електронні орбіталі мають різну форму (рис. 3.2), то їхнє взаємне перекривання може здійснюватись різними способами. Залежно від способу перекривання електронних орбіталей розрізняють (сигма) σ-, (пі) π- і (дельта) δ-зв'язки (рисунок 3.3).

Рисунок 3.3 – Схема перекривання електронних орбіталей
σ-Зв'язок здійснюється в результаті перекривання електронних орбіталей вздовж лінії, яка з'єднує два ядра. Він може утворюватись за рахунок двох s-електронів, одного s-і одного р-електрона, двох p-електронів, двох d-електронів. σ-Зв'язок завжди одинарний, тобто утворюється за рахунок однієї електронної пари.
π-Зв'язок виникає в результаті перекриванні електронних орбіталей по обидва боки від лінії, яка з'єднує ядра атомів (перпендикулярно до осі зв'язку). Вони утворюються лише р-, d- і f-орбіталями. Такий зв’язок характерний для молекули азоту (рис. 3.2), де із трьох зв'язків один – σ-зв'язок, а два інші – π-зв'язки. Тому ця молекула дуже стійка, що пояснює "інертність" азоту, Е =945,6 кДж/моль, l= 0,109 нм.
δ-Зв'язок зумовлений перекриванням усіх чотирьох пелюсток
d-електронних орбіталей, розміщених у паралельних площинах.
d-електронних орбіталей, розміщених у паралельних площинах.
Хімічний зв'язок, утворений більш ніж однією електронною парою, називається кратним. Підвищення кратності зв'язку призводить до зміцнення міжатомного зв'язку і зменшення між'ядерної відстані (довжини зв'язку). Наприклад, енергія дисоціації молекул F2 і N2 відповідно дорівнює 159 і 946 кДж/моль. У молекулах С2Н6 (Н3С—СН3), С2Н4(Н2С==СН2) і С2Н2(НС≡≡СН) відстань між ядрами атомів Карбону з підвищенням кратності зв'язку зменшується і відповідно дорівнює: 0,1543; 0,1353 і 0,1205 нм.
Концепція гібридизації виникла внаслідок необхідності привести до відповідності теорію з практикою: орбіталі центрального атома, які беруть участь в утворенні σ-зв'язків, вирівнюються за формою і енергією, тобто із декількох нерівноцінних орбіталей утворюється стільки ж "гібридних", однакових за формою і енергією. Гібридизуватися можуть одно-, двоелектронні і вільні орбіталі (рисунок 3.4).

Рисунок 3.4 – Гібридизація атомних орбіталей
Розрізняють: sp, sp2, sp3, sp3d i sp3d2 гібридні орбіталі, де літери s, p і d показують вид гібридизованих орбіталей, а верхній індекс – число орбіталей даного виду (рисунок 3.4, таблиця 3.1).
Таблиця 3.1 – Основні типи гібридизації АО
Структура
|  |  |  |
Сполука
|
BeCl2
|
BH3
|
CH4
|
Число електронних пар
|
2
|
3
|
4
|
Тип гібридизації
|
sp
|
sp2
|
sp3
|
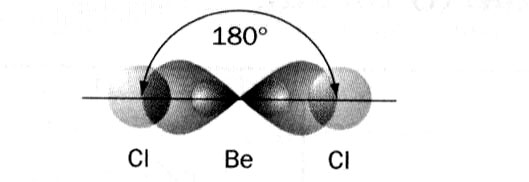
Під час sp-гібридизації гібридизується одна s- і одна р-орбіталь з утворенням двох гібридних орбіталей. sp-Орбіталь здатна до більш глибокого перекриття, утворює більш вигідний у енергетичному відношенні зв'язок. Валентний кут дорівнює 180°.
В результаті sp2-гібридизації гібридизується одна s- і дві р-орбіталі, розміщені в одній площині з валентним кутом 120°.
Під час sp3-гібридизації гібридизується одна s- і три р-орбіталі, найбільш симетричною є тетраедрична конфігурація гібридних орбіталей з валентним кутом 109°28' та інші.
Гібридизація підвищує міцність зв'язку. Наприклад, в результаті sp3-гібридизації – у два рази більше відносно s-s зв'язку.
Геометрія молекул визначається типом гібридизації центрального атома (запропоновано вперше Р. Гіллеспі, який поклав в основу модель відштовхування локалізованих електронних пар).
Якби усі гібридні орбіталі центрального атома (ЦА) брали участь в утворенні зв'язків, то кожному типу гібридизації відповідав би один геометричний вид молекули.
Однак, центральний атом не завжди може використати свої гібридні орбіталі, тому одному й тому ж типові гібридизації ЦА можуть відповідати декілька типів молекул, які відрізняються складом і геометрією (рисунок 3.5).

Рисунок 3.5 – Геометрія молекул із sp3-гібридизацією
Як видно на рисунку 3.5, молекули із sp3-гібридизацією мають різні геометричні форми: СН4 – тетраедрична форма; NH3 – пірамідальна; Н2О – кутова. Величини їхніх валентних кутів (валентний кут – це кут, утворений напрямком сусідніх зв’язків) близькі до тетраедричного (109°28').
Різниця між цими молекулами полягає в числі приєднаних атомів Гідрогену, що пов’язано з різною електронною заселеністю гібридних орбіталей атомів Карбону, Нітрогену і Оксигену.

Збуджений атом Карбону заселяється чотирма електронами, утворюючи σ - зв'язки за участю всіх чотирьох гібридних орбіталей. В молекулі метану, де один σ-зв'язок (s-s перекривання) повинен відрізнятися від трьох інших
σ-зв'язків (s-р перекривання). В дійсності, в молекулі метану усі чотири
σ-зв'язки С–Н є рівноцінними:
σ-зв'язків (s-р перекривання). В дійсності, в молекулі метану усі чотири
σ-зв'язки С–Н є рівноцінними:

Атом Нітрогену приєднує три атоми Гідрогену, утворюючи пірамідальну молекулу, а невикористана неподілена пара електронів відштовхує від себе зв'язки N–Н, зменшуючи валентний кут.
Ще більший вплив на валентний кут мають дві неподілені пари електронів атома Оксигену у молекулі води. Однак, валентні кути багатьох сполук не відповідають тим величинам, які витікають із характеру розподілу електронної густини у вільних атомів.
Крім розглянутих вище можливі й інші типи гібридизації АО і відповідні їм просторові конфігурації молекул. У елементів третього і наступних періодів в утворенні гібридизованих зв'язків можуть брати участь d-і f-орбіталі. Комбінація однієї s-, трьох р- і однієї d-орбіталей приводить до sp3d-гібридизації. Це відповідає просторовій орієнтації sp3d-гібридизованих орбіталей до вершин тригональної біпіраміди (таблиця 3.2). У випадку
sp3d2-гібридизації шість sp3d2-гібридизованих орбіталей орієнтовані до вершин октаедра (таблиця 3.2). Орієнтація семи орбіталей до вершини пентагональної біпіраміди (таблиця 3.2) відповідає sр3d3- або sр3d2f-гібридизації валентних орбіталей центрального атома молекули (комплексу).
sp3d2-гібридизації шість sp3d2-гібридизованих орбіталей орієнтовані до вершин октаедра (таблиця 3.2). Орієнтація семи орбіталей до вершини пентагональної біпіраміди (таблиця 3.2) відповідає sр3d3- або sр3d2f-гібридизації валентних орбіталей центрального атома молекули (комплексу).
Структуру молекули встановлюють електронографічним методом (дифракція електронів) або за допомогою рентгеноструктурного аналізу.
Таблиця 3.2 – Просторова конфігурація деяких молекул і комплексів
К.ч.
атома
|
Тип
молекули
|
Валентні
орбіталі
|
Геометрія
молекули
|
Приклади молекул,
йонів, комплексів
|
2
|
АВ2
|
sp
|
лінійна
|
ВеСl2, ZnCl2, CO2
|
sр2
|
кутова
|
H2Se, H2O
| ||
3
|
АВ,
|
sp2
|
трикутна
|
ВеH
|
sp3
|
пірамідальна
|
NН3, SbH3,
| ||
4
|
АВ4
|
sp3
|
тетраедрична
квадратна
|
СН4, NH
|
sp2d
|
PtCl
| |||
5
|
АВ5
|
sp3d
|
біпірамідальна
|
РСl5
|
6
|
АВ6
|
sp3d2
|
октаедрична
|
SF6, SiF
|
Нелокалізований зв’язок
Нелокалізований π-зв’язок. Це поняття введено для пояснення дослідних даних стосовно структур багатьох молекул та йонів. Метод валентних зв'язків виходить з положення, що хімічний зв'язок між атомами в молекулі локалізований, тобто електронна пара одночасно належить двом атомам (зв'язок двох центровий). Проте іноді, виходячи з властивостей багатоатомних молекул, допускають, що при утворенні хімічного зв'язку електронні пари можуть розміщуватись між кількома атомами (зв'язок багато центровий) так, що неможливо точно визначити, яким саме атомам належать окремі пари електронів. Такі зв'язки називаються нелокалізованими. Прикладом йонів з нелокалізованими зв'язками є карбонат- і нітрат-йони:

В методі ВЗ будова аніона СО зображується набором із трьох рівноцінних схем:
зображується набором із трьох рівноцінних схем:

Припустивши делокалізацію π-зв'язку і негативного заряду на всі атоми Оксигену, можна обмежитися однією схемою, в якій зображення делокалізованого π - зв'язку таке:

Кратність зв’язку С==О складає 1,333, lC-O = 1,29 Å, що є проміжною величиною між довжиною ординарного і подвійного зв’язку (lC-O = 1,42Å і
lC=O = 1,22Å.
lC=O = 1,22Å.
Делокалізований π-зв'язок має місце в бензені, а також багатьох інших молекулах, його зображують штриховою лінією. Кожний з 6 атомів Карбону у молекулі C6H6 знаходиться в стані sр2-гібридизації і зв’язаний із двома сусідніми атома Карбону і атомом Гідрогену трьома σ-зв'язками, утворюючи шестикутник. Шість р-електронних хмар атомів Карбону утворюють три π-зв'язки між кожними двома атомами. Таким чином, виникають дві ділянки підвищеної електронної густини, розташовані з обох боків площини, σ-зв'язків. Отже, в молекулі бензену хімічні зв'язки, що знаходяться в площині бензольного ядра, локалізовані (σ-зв'язки), π-зв'язки, які розташовані перпендикулярно до площини ядра – нелокалізовані.

Насичуваність зв'язку. Атом прагне як можна повніше використати свої валентні властивості і утворити максимальне число зв'язків. Валентність – це число утворених атомом зв'язків; вона не має знаку, не розраховується за формулою сполуки і не враховує структуру молекули. Наприклад: ізольована молекула FeCl3 (за Т > 750° – газоподібний стан), атом Феруму має три зв'язки; за більш низьких температур утворюються димери Fe2Сl6, у яких атом Феруму має чотири зв'язки, тоді як у кристалі Ферум зв'язаний з шістьома атомами Хлору:

Отже, в мономері валентність Феруму три, у димері – чотири і у кристалі – шість.
Оскільки можливості кожного атома обмежені, тому й існує межа зниження повної енергії системи; ця властивість хімічного зв'язку називається насичуваністю. Максимальне число зв'язків, яке може мати атом, називається його максимальною валентністю. Вона визначається числом валентних орбіталей атома, здатних приймати участь в утворенні зв'язків, незалежно від їх заселеності електронами (таблиця 3.3).
Таблиця 3.3 – Валентні орбіталі і максимальна валентність
елементів різних періодів
елементів різних періодів
Період
|
Елементи
|
Валентні орбіталі
|
Максимальна валентність
|
1
|
s
|
Is
|
1
|
2
|
s, p
|
2s,2p
|
4
|
3
|
s, p
|
3s,3p,3d
|
6
|
4
|
s, p
|
4s,4p,4d
|
6
|
5
|
s, p
|
5s,5p,5d,5f
|
8
|
6
|
s, p
|
6s,6p,6d,6f
|
8
|
4-6
|
d
|
(n-1) d, ns, np
|
9
|
Якщо всі валентні орбіталі атом використовує для утворення зв'язків, то координаційне число атома, дорівнює його максимальній валентності; такий стан називається координаційно-насиченим, такі сполуки стійкі і хімічно інертні, так як система характеризується мінімумом енергії. Сюди належать насичені вуглеводні, йон амонію та ін.

Поряд з утворенням σ -зв'язків, в атомі можуть бути π- і δ-зв'язки. Стан атома, коли загальне число утворених ним зв'язків дорівнює його максимальній валентності, називається валентно-насиченим. Такі сполуки достатньо стійкі, але хімічно активні, здатні до реакцій, в яких π- і δ-зв'язки замінюються на енергетично більш вигідні σ-зв'язки. Наприклад, ненасичені вуглеводні, які мають π-зв’язки і у яких атоми вуглецю координаційно-ненасичені:

Прагнення до координаційного насичення зумовлює їх хімічну активність (характерні реакцій приєднання, полімеризації, під час яких
π- зв'язки замінюються σ-зв'язками).
π- зв'язки замінюються σ-зв'язками).
Якщо число утворених атомом зв’язків менше його максимальної валентності, то такий стан атома називають валентно-ненасиченим (сполуки з такими атомами нестійкі, дуже реакційноздатні, наприклад: NaH, CaH2, CO, NH3).
Полярність та поляризованість зв'язку
У випадку, коли електронна пара належить в рівній мірі обом атомам, утворюється ковалентний неполярний зв'язок (рисунок 3.6 а), характерний для газів: Н2,О2,Cl2, N2, (неполярні молекули). Якщо ж електронна пара зміщена до атома з більшою електронегативністю, утворюється ковалентний полярний зв'язок (рисунок 3.6 б): H2O, HCl, NH3 (полярні молекули або диполі).
 |  |
а
|
б
|
Рисунок 3.6 – Неполярний (а) та полярний (б) ковалентний зв’язок
(де δ – ефективні заряди, l – довжина диполя)
(де δ – ефективні заряди, l – довжина диполя)
Поляризованість зв'язку – це здатність ковалентного зв'язку перетворюватись на полярний або більш полярний під дією зовнішнього електричного поля або електричного поля інших атомів, молекул.
Кількісною мірою полярності молекули є величина дипольного моменту ц, який являє собою добуток: μ = δ · l [Кл·м].
Дипольний момент – це векторна величина (вектор, напрямлений від позитивно зарядженої частини (кінця) диполя до негативно зарядженого). Сумарний дипольний момент молекули дорівнює векторній сумі дипольних моментів окремих зв'язків та неподілених електронних пар. Тому можуть існувати неполярні молекули з полярним типом зв'язку, коли μ = 0, наприклад, молекула СO2:

До неполярних відносяться і такі симетричні молекули (С6Н6, CF4, SF6, СН4 та ін.), для яких  .
.
В молекулі води, яка має кутову форму, полярні зв’язки Н–О розташовані під кутом 105º. Через це їх дипольні моменти не компенсуються, і молекула є полярною:

На дипольний момент суттєво впливають неподілені електронні пари. Наприклад, молекули NH3 і NF3 мають однакову пірамідальну форму, полярність зв’язків N–H та N–F теж приблизно однакова, але дипольні моменти різні (рисунок 3.7). Причина в тому, що в молекулі NH3 напрямок дипольного моменту зв’язку N–H і електронної пари співпадають, а в NF3 моменти зв’язків N–F і електронної пари напрямлені в протилежні сторони.

Рисунок 3.7 – Внески в дипольний момент молекул NH3 (а) та NF3 (б)
У хімічних сполуках поляризація виникає під дією близько розміщених йонів, при цьому ступінь поляризації залежить від заряду і радіусу як поляризованого йона, так і йона з поляризуючою дією. Мірою поляризованості є запропонований Н.І.Блоком йонний потенціал – відношення величини заряду до радіуса йона z/r. Чим більше це відношення, тим більший заряд і менший радіус, такий йон сам менше здатний до поляризації і більше впливає на поляризуючий ефект. І навпаки, менша величина z/r свідчить про значно більшу здатність йона до поляризації і зменшення його поляризуючих властивостей по відношенню до інших йонів. Ступінь поляризації йона визначає характер його зв'язку з іншими йонами і, як наслідок, міцність цього зв'язку. При зростанні поляризуючих властивостей йонів міцність зв'язків (ковалентність) катіонів з аніонами (за інших рівних умов) зростає, що знижує розчинність осадів. Наприклад, в ряду: BaF2→SrF2→CaF2 розчинність знижується внаслідок збільшення z/r (Ba2+ -14,0; Sr2+ -15,7; Са2+ -18,9). Зі зростанням заряду катіона його поляризованість зменшується, оскільки паралельно зменшується його радіус внаслідок більш сильного притягання електронних оболонок до ядра. Тип електронної оболонки впливає на поляризованість йона. Меншу здатністю до поляризації мають електрони з малою 2 або 8-електронною оболонкою, більшу – із 18- або (18+2)-електронною оболонкою.
Ступінь поляризації йонів впливає на їх здатність поглинати кванти світлового випромінювання (розщеплення орбіталей), що призводить до появи забарвлення у сполук. Сполуки s - елементів, як правило, не забарвлені, у сполук р- і d- елементів часто з'являється забарвлення внаслідок сильної поляризації аніонів під дією катіона (сульфіди Рb2+, Sb3+, Bi'+, Cd2+).
3.3 Теорія молекулярних орбіталей МО ЛКАО
Метод ВЗ дає теоретичне обґрунтування структурним формулам, він простий і наглядний. Однак, цей метод не в змозі пояснити існування молекул 8 непарним числом електронів і магнітні властивості сполук, їх забарвлення.
У методі молекулярних орбіталей молекула розглядається як єдине ціле, де кожний електрон рухається в полі інших електронів і ядер. Стан молекули описується сукупністю електронних і молекулярних орбіталей. Скорочена назва цього методу М0 ЛКАО розшифровується так: молекулярна орбіталь – лінійна комбінація атомних орбіталей.
Кожній молекулярній орбіталі (МО) відповідає певний набір молекулярних квантових чисел: n = 1, 2, 3, 4… l = 0, 1, 2… n-1; ms = 0,±1, ±2, ±3... ±(n-1).
ms Характеризує момент власного руху  і набуває тільки двох значень. На МО також не може міститися більше, ніж 2 електрони. Електрони заповнюють МО згідно із принципом Паулі та правилом Гунда в міру підвищення їх енергетичного рівня.
і набуває тільки двох значень. На МО також не може міститися більше, ніж 2 електрони. Електрони заповнюють МО згідно із принципом Паулі та правилом Гунда в міру підвищення їх енергетичного рівня.
Описати молекулу за методом МО означає визначити тип її орбіталей, їх енергію, розподіл електронів по орбіталям.
За формою МО більш складні, ніж АО, так як вони є багато центровими. Молекулярні орбіталі можна уявити як лінійну комбінацію атомних орбіталей (як результат додавання і віднімання комбінації атомних орбіталей) В результаті комбінації N-числа АО утворюється N-число молекулярних орбіталей. Отже, молекула або комплекс розглядається в ММ0 як єдине ціле.
Зв’язуючі та розпушуючі молекулярні орбіталі
Відповідно до методу МО-ЛКАО лінійна комбінація атомних орбіталей здійснюється двояко: або додаванням (знаки функції однакові і додатні) або відніманням (знаки функції різні). Це можна записати так:
ψ+ = a1ψ1 + a2ψ2
ψ- = a3ψ3 + a4ψ4
де а1, а2, а3, і а4 – коефіцієнти, які можуть мати різні значення; вони показують, який внесок відповідних атомних орбіталей у формування молекулярних орбіталей. При утворенні молекули водню внесок атомних орбіталей однаковий, тобто а1= а2 і а3= а4. Отже,
ψ+ = ψ1 + ψ2
ψ- = ψ3 + ψ4
Додавання ψ1 і ψ2 призводить до збільшення значення хвильової функції у просторі між ядрами взаємодіючих атомів і густина електронної хмари у між'ядерному просторі зростає, що зумовлює взаємне притягання атомних ядер, тобто утворення хімічного зв'язку. Тому орбіталь ψ1 і ψ2 називається зв'язуючою, а електрони на цій орбіталі – зв'язуючими. Взаємодія хвильових функцій з утворенням зв'язуючої орбіталі відбувається екзотермічно – з виділенням енергії. Електрон, який перебуває на зв'язуючій МО, має меншу енергію, ніж вихідний атом водню. Якщо хвильові функції ψ1 і ψ2 віднімаються то абсолютне значення хвильової функції у просторі між ядрами зменшується. Це означає, що при утворенні молекулярної орбіталі ψ– густина електронної хмари у між'ядерному просторі зменшується, внаслідок чого молекулярні атомні ядра притягуються не до між'ядерної області, а до периферії молекули, тобто ніби відштовхуються одне від одного. В даному випадку хімічний зв'язок між атомами не виникає. Тому орбіталь ψ_ називається розпушуючою, а електрони на ній – розпушуючими. Утворення розпушуючої орбіталі відбувається ендотермічно, потребує затрати енергії, а тому електрон, який перебуває на ній, характеризується більшою енергією, ніж у вихідному атомі водню. Оскільки s-орбіталі Гідрогену утворюють лише σ-зв'язки, то молекулярні орбіталі позначаються: σзв1s (сигма-зв'язуюча) і σ*1s (сигма-розпушуюча).

Рисунок 3.8 – Лінійна комбінація АО з утворенням в’язуючих та розпушуючих орбіталей
Отже, замість двох енергетично рівноцінних 1s-орбіталей у вихідних атомів Гідрогену при утворенні молекули водню виникає дві енергетично нерівноцінні молекулярні орбіталі —зв'язуюча σзв1s і розпушуюча σ*1s (рисунок 3.8). Іншими словами, вихідний енергетичний рівень розщеплюється на два: один розміщений нижче, а другий — вище від вихідного.
Утворення молекулярних орбіталей з атомних зображують у вигляді енергетичної діаграми, в якій по вертикалі відкладають значення енергії (Е). На рисунку 3.9 подано зображення енергетичної схеми рівнів атомних і молекулярних орбіталей Гідрогену.

Рисунок 3.9 – Енергетична діаграма утворення МО водню
Розподіл електронів по енергетичних рівнях молекули та її орбіталях дозволяє пояснити багато властивостей молекул.
Використавши вище наведену діаграму, розглянемо можливість утворення Н2+, Н2, Не2+, Не2 (таблиця 3.4).
а) Молекулярний йон Н складається із двох протонів і одного електрона, який повинен займати вигідну орбіталь
складається із двох протонів і одного електрона, який повинен займати вигідну орбіталь  . Отже, електронна формула іона Н
. Отже, електронна формула іона Н в основному стані:
в основному стані:
Н [(
[( )І].
)І].
б) В молекулі Н2 два електрони, які за принципом Паулі і законом мінімуму енергії також заселяють  -орбіталь. Реакцію утворення молекули водню із атомів за методом МО можна записати так:
-орбіталь. Реакцію утворення молекули водню із атомів за методом МО можна записати так:
2Н (1s1) = Н2[( )2]
)2]
Перехід 1s-електронів на  -орбіталь відповідає виділенню енергії (Е = -435 кДж/моль).
-орбіталь відповідає виділенню енергії (Е = -435 кДж/моль).
в) В молекулярному дигелій-йоні Не три електрона, два із них заселяють зв'язуючу, третій – розпушуючу орбіталь:
три електрона, два із них заселяють зв'язуючу, третій – розпушуючу орбіталь:
Не [(
[( )2 (
)2 ( )І]
)І]
г) В системі із двох атомів Гелію Не2 чотири електрони, два із них на зв’язуючій і два – на розпушуючій орбіталі:
Не2[( )2 (
)2 ( )2]
)2]
Така молекула існувати не може (див. нижче).
Енергія, довжина і порядок (кратність) зв'язку
За характером розподілу електронів по МО можна оцінити енергію, довжину і порядок зв'язку.
В ряду Н → Н2 → Нe
→ Н2 → Нe → Нe2 в міру заповнення зв'язуючої орбіталі електронами енергія дисоціації (зв'язку) молекул зростає, але за появи електрона на розпушуючій МО, навпаки, зменшується. Між’ядерна відстань спочатку зменшується, а потім збільшується.
→ Нe2 в міру заповнення зв'язуючої орбіталі електронами енергія дисоціації (зв'язку) молекул зростає, але за появи електрона на розпушуючій МО, навпаки, зменшується. Між’ядерна відстань спочатку зменшується, а потім збільшується.
Молекула Нe2 в не збудженому стані існувати не може, так як число зв'язуючих і розпушуючих електронів у неї однакове і кратність зв'язку дорівнює нулю.
Кратність (порядок) зв'язку розраховують за формулою:
КЗ = 
Таблиця 3.4 – Заповнення валентними електронами орбіталей молекул Н2 і Не2 та йонів Н і Не
і Не
Частинка
|
Н
|
Н2
|
Не
|
Не2
|
Число електронів
|
1
|
2
|
3
|
4
|
Електронна
формула
| ||||
Кратність зв’язку
|
1/2
|
1
|
1/2
|
0
|
Енергія зв’язку кДж/моль
|
277
|
435
|
230
|
–
|
Між’ядерна відстань, А
|
1,06
|
0,721
|
1,08
|
–
|
Магнітні властивості
|
Парамагнітна
|
Діамагнітна
|
Парамагнітна
|
–
|
В ряду Н → Н2 → Нe
→ Н2 → Нe → Нe2 в міру заповнення зв'язуючої орбіталі електронами енергія дисоціації (зв'язку) молекул зростає, але за появи електрона на розпушуючій МО, навпаки, зменшується. Між’ядерна відстань спочатку зменшується, а потім збільшується.
→ Нe2 в міру заповнення зв'язуючої орбіталі електронами енергія дисоціації (зв'язку) молекул зростає, але за появи електрона на розпушуючій МО, навпаки, зменшується. Між’ядерна відстань спочатку зменшується, а потім збільшується.
Молекула Нe2 в не збудженому стані існувати не може, так як число зв'язуючих і розпушуючих електронів у неї однакове і кратність зв'язку дорівнює нулю.
Кратність (порядок) зв'язку розраховують за формулою:
КЗ = 
Метод МО ЛКАО дає можливість охарактеризувати магнітні властивості молекул. За магнітними властивостями речовини поділяються на групи: діамагнітні, парамагнітні і феромагнітні. Кількісно вони характеризуються величинами магнітної сприйнятливості. (К) і магнітного моменту μ. Мольна сприйнятливість  , М – молярна маса, ρ - густина речовини. Діамагнітна сприйнятливість має від’ємний знак, парамагнітна – додатний. Парамагнетики – кисень, оксид Нітрогену, оксид Хлору (ІУ), кристали металів: натрію, калію, алюмінію та ін. притягуються зовнішнім магнітним полем. Для парамагнетизму характерна наявність неспарених електронів.
, М – молярна маса, ρ - густина речовини. Діамагнітна сприйнятливість має від’ємний знак, парамагнітна – додатний. Парамагнетики – кисень, оксид Нітрогену, оксид Хлору (ІУ), кристали металів: натрію, калію, алюмінію та ін. притягуються зовнішнім магнітним полем. Для парамагнетизму характерна наявність неспарених електронів.
Діамагнетики (метали 1В, 2В, Ве, Ві та ін.) відштовхуються зовнішнім магнітним полем. Про діамагнетизм свідчать спарені електрони.
Феромагнітними називаються речовини з дуже високою магнітною сприйнятливістю – залізо, кобальт, нікель.
Гомо ядерні молекули 2 періоду
У елементів 2 періоду крім 1s-орбіталей в утворенні МО приймають участь 2s-, 2p-орбіталі (таблиця 3.5; 3.6).
Комбінація орбіталей відповідає утворенню двох МО  і
і  , причому, орбіта лі розміщуються в порядку зростання енергії:
, причому, орбіта лі розміщуються в порядку зростання енергії:
Комбінація орбіталей р-типу відрізняється, як і при утвореній σ- і
π-зв'язків (в залежності від способу перекривання). При комбінації АО 2px виникають МО:
 , тоді як комбінація 2py, або 2pz дає π-орбіталі:
, тоді як комбінація 2py, або 2pz дає π-орбіталі:
π-зв'язків (в залежності від способу перекривання). При комбінації АО 2px виникають МО:
Під час утворення молекули електрони розміщуються на орбіталях із найбільш низькою енергією.
Так процес утворення молекули Li2 можна записати:
2 Li [K 2s]  Li2[KK (
Li2[KK ( )2] або Li2 [KK (
)2] або Li2 [KK ( )2]
)2]
КК – електронна конфігурація атома Гелію, так як електрони першого електронного рівня участі в утворенні зв’язку не приймають, а складають остов.
Молекула Be2[KK( )2(
)2( )2], де кратність зв’язку рівна нулю, існувати не може.
)2], де кратність зв’язку рівна нулю, існувати не може.
Таблиця 3.5 – Заповнення валентними електронами орбіталей молекул В2, С2 N2та йона N
Молекули
|
В2
|
С2
|
N2
|
N2+
|
Число валентних електронів
|
6
|
8
|
10
|
9
|
Кратність зв’язку
|
1
|
2
|
3
|
2,5
|
Енергія зв’язку, кДж/моль
|
288,4
|
627
|
940
|
828
|
Між’ядерна відстань, А
|
0,159
|
0,131
|
0,110
|
0,112
|
Магнітні властивості
|
Парамагнітна
|
Діамагнітна
|
Діамагнітна
|
Парамагнітна
|
Таблиця 3.6 – Заповнення валентними електронами орбіталей
молекул О2, F2 Ne2та йона O
молекул О2, F2 Ne2та йона O
Молекули
|
O
|
O2
|
F2
|
Ne2
|
Число валентних електронів
|
11
|
12
|
14
|
16
|
Кратність зв’язку
|
2,5
|
2
|
1
|
0
|
Енергія зв’язку, кДж/моль
|
629
|
494
|
151
|
–
|
Між’ядерна відстань, А
|
0,112
|
0,121
|
0,142
|
–
|
Магнітні властивості
|
Парамагнітна
|
Парамагнітна
|
Парамагнітна
|
Не існує
|
Таким чином, в молекулі кисню розподілено 12 електронів так, що два із них  – неспарені, що зумовлює парамагнітні властивості молекули. Ці властивості неможливо пояснити методом ВЗ (0=0) , за яким в молекулі О2 не має неспарених електронів.
– неспарені, що зумовлює парамагнітні властивості молекули. Ці властивості неможливо пояснити методом ВЗ (0=0) , за яким в молекулі О2 не має неспарених електронів.
Гетероядерні двоатомні молекули та йони елементів 2 періоду
Вивчення молекулярних спектрів гетероядерних двоатомних молекул, утворених елементами 2-го період, показує однакову послідовність збільшення енергії МО (таблиця 3.7).
В молекулі СО 10 валентних електронів, які розміщені на МО аналогічно молекулі N2 і її електронна будова така ж:
СО [KK ( )2(
)2( )2(
)2( )2(
)2( )2(
)2( )2]
)2]
Тому у них близькі фізичні властивості, а надлишок σ-зв'язуючих електронів приводить до висновку, що зв'язок в них потрійний: С≡≡С. Молекули такого типу називаються ізоелектронними. Таким чином, ізоелектронними будуть також, крім СО, СN- і N0+, які містять 10 валентних електронів.
Таблиця 3.7 – Заповнення валентними електронами орбіталей молекул N2, СО, СN, NO, та йона NO
Молекули
|
N2
|
СО
|
СN
|
NO
|
NO+
|
Число валентних електронів
|
10
|
10
|
10
|
11
|
10
|
Кратність зв’язку
|
3
|
3
|
3
|
2,5
|
3
|
Енергія зв’язку, кДж/моль
|
940
|
1071
|
940
|
623
|
1050
|
Між’ядерна відстань, А
|
0,110
|
0,113
|
0,118
|
0,114
|
0,106
|
Магнітні властивості
|
Діамагнітна
|
Діамагнітна
|
Діамагнітна
|
Парамагнітна
|
Діамагнітна
|
3.4 Характерні особливості йонного зв'язку: ненасиченість і ненапрямленість
Природу йонного зв'язку, будову і властивості йонних сполук можна пояснити з позицій електростатичної теорії хімічного зв'язку: хімічна взаємодія трактується як процес утворення йонів, які потім взаємодіють за рахунок електростатичних сил. Наприклад:

Зв'язок, який виникає у результаті електростатичної взаємодії катіонів і аніонів, називається йонним. Він характеризується ненапрямленістю і ненасичуваністю.
Йони можна уявити як заряджені кулі, силові поля яких рівномірно розподілені в усіх напрямках у просторі. Тому кожен йон може притягувати до себе йони протилежного знаку у будь-якому напрямку, що характеризує ненапрямленість йонного зв'язку.
 |
Взаємодія двох йонів протилежного знаку не може привести до повної взаємної компенсації їх силових полів, тому вони зберігають здатність притягувати йони протилежного знаку і в інших напрямках, що характеризує ненасиченість йонного зв'язку.
|
Структура йонних сполук
Енергетично найбільш вигідно, коли кожний йон оточений максимальним числом йонів протилежного знаку, які взаємно скоординовані залежно від їх розмірів. При співвідношенні йонних радіусів у межах 0,41… 0,73 має місце октаедрична координація йонів; при співвідношенні 0,73 …1,37 – кубічна координація та ін. Наприклад: rNa+ = 0,098 нм і rCl- =0,181 нм співвідношення 0,098 /0,181 = 0,54, що приводить до виникнення октаедричної координації.
В звичайних умовах йонні сполуки є кристалічними речовинами. Поняття простих двойонних молекул типу NaCl та інших для них втрачає зміст, оскільки весь кристал потрібно розглядати як гігантську молекулу: Nan+ Cln – .
Речовини з йонним зв'язком, як правило, добре розчинні у воді, мають високі температури плавлення, кипіння, електропровідні.
В йонних сполуках кожний йон знаходиться в електричному полі йонів протилежного знаку. Електричні хмаринки цього йона деформуються, зміщуються до протийона, що призводить до часткової нейтралізації заряду і його зменшення. Наприклад, у NaCl ефективний заряд дорівнює +0,8 (Na) і - 0,8(Сl) відповідно, а не +1 і -1, що зумовлене поляризацією йонів.
3.5 Металічний зв’язок
У вузлах кристалічної ґратки металів знаходяться атоми, які мають від 1 до 3 електронів, що зумовлює невелику електронну густину на зовнішньому рівні. Тому в процесі кристалізації атоми легко зближуються і узагальнюють електрони (узагальнені електрони називають електронний газ або електрони провідності). Обмін електронами надає остову атома позитивний потенціал, хоча він і відрізняється від йона. Наявність електронного газу пояснює добру тепло- і електропровідність металів. Крім електростатичної взаємодії (кулонівські сили), мають місце особливі обмінні та інші сили квантово-механічного походження.

Рисунок 3.10 – "Електронний газ" у кристалі металу
Особливість цих сил – їх ненапрямленість і ненасиченість, а для кристалічної структури – великі координаційні числа – 8 або 12, їм відповідає значна густина упакування, яка визначається тим, що йони металу вкладаються у просторі як кулі однакового розміру.
Кристалічна гратка металів поділяється на три види (рисунок 3.11):

а – об'ємноцентрований куб (з координаційним числом (к.ч.) 8); б – гранецентрований куб (з к.ч. 12); в – гексагональна структура (Г-12)
Рисунок 3.11 – Кристалічні гратки металів
Отже, у металах має місце сильно делокалізований хімічний зв'язок, який характеризується високою міцністю, яка визначається енергією атомізації металу (переведення металу з твердого стану у поодинокі атоми).
3.6 Водневий зв'язок
Дані експерименту свідчать про те, що атом Гідрогену здатний з'єднуватися одночасно з двома іншими атомами, що входять до складу різних або однієї й тієї ж молекули.
При цьому, наприклад, ковалентно зв'язаний атом Гідрогену з більш електронегативним атомом А, утворює інший зв'язок з атомом В, поляризованим негативно і який має неподілену електронну пару:

Такий зв'язок характерний для атома Гідрогену і називається водневим. Водневий зв'язок за міцністю перевищує ван-дер-ваальсову взаємодію, але поступається міцності ковалентного зв'язку: 16-33 кДж / моль; 4-27 кДж / моль і 40 - 250 кДж / моль відповідно.
Водневий зв'язок має електростатичний характер, обумовлений тим, що при утворенні сильно поляризованого зв'язку Аδ-–––Нδ+ електронна пара зміщується від атома Гідрогену до атома елементу А, оголюючи протон (ядро). Останній, маючи позитивний заряд і дуже малий розмір, здатний втілюватися в електронну оболонку сусіднього негативно поляризованого атома В. За такою схемою молекула води може утворити чотири водневих зв'язки з іншими молекулами:

З іншого боку, водневий зв'язок має ковалентний характер, оскільки атом Гідрогену має одну валентну орбіталь, яка стає практично вільною внаслідок сильної поляризації зв'язку А––Н, і здатна до часткового перекривання з двоелектронною орбіталлю атома В (ковалентний зв'язок, утворений за донорно-акцепторним механізмом).
Таким чином, водневий зв'язок зумовлений як електростатичною, так і донорно-акцепторною взаємодією, але перший фактор вносить незрівнянно більший внесок.
Міцні водневі зв'язки виникають між молекулами водневих сполук Флуору, Оксигену і Нітрогену. Так, HF навіть у парі існує у вигляді полімерів (HF)n, де n = 4…6; в водних розчинах - у вигляді димерів H2F2, які дисоціюють ступінчасто: Н2 F2 H+ + HF2  H
H + 2F
+ 2F
Це підкріплюється наявністю солей KHF2, NH4HF2. Полімери (HF)n мають будову зигзагоподібних ланцюгів:

Розрізняють внутрішньомолекулярний (а) і міжмолекулярний – водневий зв'язок (б):

Міжатомний водневий зв'язок виявляється у йонах типу [HF2];
[Н(Н2О)2]+ – це найбільш міцний водневий зв'язок (80 - 150 кДж / моль).
Значення водневих зв'язків
Такі зв'язки енергетично вигідні, характеризуються низькою енергією активації, сильно впливають на фізичні і хімічні властивості водневих сполук, зумовлюючи їх асоціацію, аномальні температури плавлення, кипіння та інші властивості, структуру і високу розчинність у воді.
Ця рівновага відіграє істотну роль у регулюванні температури на Земній кулі. Водневий зв'язок має велике значення в хімії, біології (механізм спадковості, дія пам'яті і ін.).
3.7 Зв'язок між типом хімічного зв'язку, будовою речовини та її фізичними властивостями. Атомні, молекулярні, йонні та металеві кристали
В залежності від зовнішніх умов речовина може бути у газоподібному, рідкому або твердому стані, що обумовлено природою матеріальних частинок (йони, атоми, прості або полімерні молекули), які утворюють цю речовину, та характеру їх взаємодії.
Кожний агрегатний стан відрізняється від іншого характером руху однієї частинки відносно другої, що залежить в свою чергу від типу взаємодії їх між собою.
Перехід від одного стану до іншого не супроводжується зміною стехіометричного складу речовини, але обов'язково пов'язаний із зміною її структури (це хімічне явище).
Сили взаємодії між молекулами або атомами називаються ван-дер-ваальсовими, вони проявляються у всіх агрегатних станах речовини, обумовлюють можливість перетворення газів в рідини і у твердий стан, їх енергія невелика (~ в 20 разів менше енергії хімічної взаємодії, біля 8-16 кДж/моль). Сили міжмолекулярної взаємодії мають електричну природу, зумовлену взаємодією диполів.
Розрізняють орієнтаційну, індукційну та дисперсійну взаємодію між молекулами.
Речовина у газоподібному стані не володіє певною формою і об'ємом, характеризується малою густиною, малою в'язкістю і здатна повністю заповнювати будь-який простір.
Стан газу характеризується його температурою, тиском і об'ємом. Газ знаходиться за нормальних умов, якщо його температура 0°С (273,15°К), тиск 760 мм рт.ст. (101,325 кПа).
Рідкий стан виникає тоді, коли сили взаємодії між частинками стають достатньо міцними, щоб чинити опір їх хаотичному переміщенню, але все ж недостатніми для того, щоб припинити переміщення однієї частинки відносно іншої.
Подібно твердим тілам, рідини володіють певною структурою наприклад, структура рідкої води нагадує структуру льоду. У ній молекули H2O також об'єднані одна з другою за рахунок водневих зв'язків і для більшості молекул зберігається тетраедричне оточення. Структура і фізичні властивості рідин залежать від хімічної індивідуальності частинок, які її утворюють, а також від характеру і інтенсивності сил, що діють між ними. Здатність молекул переміщуватися визначає можливість їх йонізації. Наприклад, молекули води, які об'єднані у тетраедричні комплекси, взаємно впливають одна на іншу, тепловий рух частинок всередині комплексу і переміщення комплексів одного відносно іншого, послаблює його. При цьому протон передається у сусідній комплекс за рахунок перетворення водневого зв'язку в ковалентний за донорно-акцепторним механізмом, що спрощено відображають таким чином:
наприклад, структура рідкої води нагадує структуру льоду. У ній молекули H2O також об'єднані одна з другою за рахунок водневих зв'язків і для більшості молекул зберігається тетраедричне оточення. Структура і фізичні властивості рідин залежать від хімічної індивідуальності частинок, які її утворюють, а також від характеру і інтенсивності сил, що діють між ними. Здатність молекул переміщуватися визначає можливість їх йонізації. Наприклад, молекули води, які об'єднані у тетраедричні комплекси, взаємно впливають одна на іншу, тепловий рух частинок всередині комплексу і переміщення комплексів одного відносно іншого, послаблює його. При цьому протон передається у сусідній комплекс за рахунок перетворення водневого зв'язку в ковалентний за донорно-акцепторним механізмом, що спрощено відображають таким чином:

Аналогічна картина утворення йонно-молекулярних комплексів має місце і у інших рідинах, молекули яких зв'язані водневими зв'язками, наприклад:

Кристалічний (твердий) стан характеризується певною орієнтацією частинок однієї відносно іншої. Це визначає і зовнішню форму твердих речовин у вигляді будь-якого багатогранника - кристала (форму кристалів вивчає геометрична кристалографія).
Основні структурні типи неорганічних сполук
Відповідно до природи складових частинок, кристалічні ґратки можуть бути йонними, атомними (ковалентними або металічними) і молекулярними. За характером міжатомних (міжйонних) відстаней, розрізняють острівні, ланцюгові, шаруваті (сітчасті) і координаційні структури.
Атомні кристали. Атомна кристалічна гратка у своїх вузлах містить атоми багатовалентних елементів, які зв'язані між собою міцними ковалентними зв'язками. Такою граткою характеризується невелике коло речовин - це елементарні і деякі складні речовини, утворені атомами Карбону, Силіцію, Германію, Бору. Їм властива дуже велика твердість, мала леткість, дуже висока температура плавлення.
Молекулярна кристалічна гратка містить у своїх вузлах молекули речовин ковалентної природи. Ці вузлові молекули зв'язані між собою слабкими ван-дер-ваальсовими силами. Така гратка характерна самим різноманітним речовинам: елементарним окисникам, благородним газам, водневим, галогенвмісним, кисневмісним сполукам неметалів, різним кислотам та органічним речовинам, їм властива (невелика) механічна міцність, порівняно велика леткість і низькі температури плавлення.
Йонна кристалічна гратка містить у своїх вузлах йони, які можна уявити як чергування зарядів протилежних за знаком, зв'язаних між собою електростатичною взаємодією.
 |  |  |
(а)
|
(б)
|
(в)
|
а – атомна кристалічна гратка; б – молекулярна кристалічна гратка; в – йонна кристалічна гратка
Рисунок 3.12 – Види кристалічних граток
Число йонів, які скоординовані навколо даного йону, називається координаційним числом. Так, наприклад, в сткруктурі NaCl йони натрію і хлорид-йони закономірно чергуються вздовж трьох взаємно перпендикулярних напрямків (рисунок 3.12 б), так що координаційне число кожного із них дорівнює 6.
Така гратка характерна різним солям, їм властива значна твердість, порівняно невелика леткість і високі температури плавлення.
Немає коментарів:
Дописати коментар